Hoá học là một trong những môn học quan trọng xuyên suốt từ lớp 8 lên lớp 9 cũng như các năm học THPT. Nhưng đây cũng được cho là một môn học khó và dễ khiến học sinh rơi vào tình trạng “mất gốc”. Cùng cô Phạm Thị Thúy Ngọc – Giáo viên môn Hóa học tại Hệ thống Giáo dục HOCMAI tìm phương pháp chống mất gốc Hóa học 8 ngay từ đầu năm học ở bài viết này nhé!
Cũng như các môn học khác, đối với môn Hóa học các bạn học sinh cũng cần chú ý nắm chắc nội dung bài học ở ngay những bài đầu tiên và phải hệ thống lại những kiến thức cơ bản cần ghi nhớ. Ở bài viết này, hãy cùng cô Ngọc hệ thống lại kiến thức và phát hiện những lỗi thường mắc phải của học sinh ở chuyên đề III Hóa học 8 (Công thức tính toán – Tính theo công thức hóa học – Tính theo phương trình hóa học).
Công thức tính toán
Để có thể làm được bài tập tính toán theo công thức thì học sinh cần phải nắm được khái niệm số mol và các công thức tính liên quan đến số mol. Mol chính là lượng chất có chứa 6.10^23 nguyên tử hoặc phân tử của chất đó.
Bên cạnh đó, thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó. (Chú ý: Một mol của bất kỳ chất nào, trong cùng điều kiện về nhiệt độ và áp suất, đều chiếm những thể tích bằng nhau. Nếu ở nhiệt độ 0oC và áp suất 1 atm thì thể tích đó là 22,4l. Tức là những chất khí khác nhau thường có khối lượng mol không như nhau, nhưng thể tích mol của chúng ở cùng điều kiện là bằng nhau.
*Ở điều kiện bình thường (20oC và 1 atm), 1 mol chất khi có thể tích là 24l.)
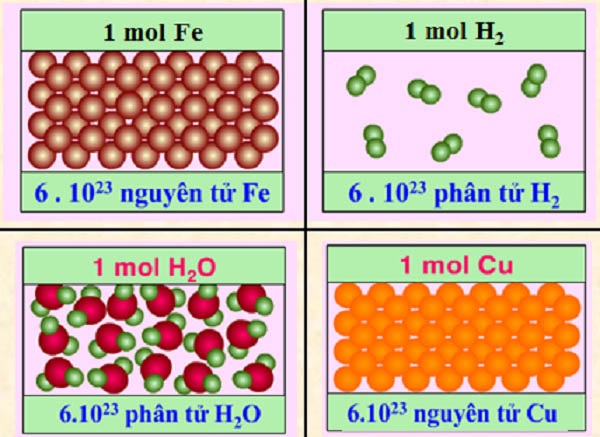
Khối lượng mol (M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó.
Công thức tính số mol theo khối lượng:
n = m/M
Trong đó:
m: khối lượng
M: khối lượng phân tử, khối lượng mol
Công thức tính số mol theo thể tích (đối với chất khí ở điều kiện chuẩn) :
n =V/22,4
Trong đó:
V: thể tích khí
Một số công thức tính cơ bản khác cần phải nhớ là:
n=m/M (mol)
m = n.M (g)
M= m/n (g/mol)
Công thức tính tỉ khối
dA/B = MA/MB
dA/không khí= MA/29
V(đktc) (l) = n.22,4
n = V (l)/22,4
Tính theo công thức hóa học
Nếu biết công thức của hợp chất ta có thể tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất đó theo các bước sau:
– Tính khối lượng mol của hợp chất AxBy:
– Xác định số mol nguyên tử của từng nguyên tố có trong 1 mol hợp chất AxBy.
1 mol AxBy có: x mol nguyên tử A và y mol nguyên tử B.
– Tìm khối lượng các nguyên tố trong 1 mol hợp chất AxBy.
mA=x.MA
mB=y.MB
– Tính phần trăm theo khối lượng của từng nguyên tố theo công thức:
%A= .100%= .100%
%B= .100%= .100%
Hoặc %B=100%-%A
Ví dụ 1: Tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất sau:
a)SO2
b)Fe2(SO4)3
Giải:
a) MSO2=32+16.2=64
1 mol SO2có 1 mol S và 2 mol O
%S= .100%= .100%=50%
%O= .100%= .100%=50%
b) =56.2+(32+16.4).3=400
1 molFe2(SO4)3có 2 mol Fe, 3 mol S và 12 mol O
%Fe= .100%= .100%=24%
%S= .100%= .100%=24%
%O= .100%= .100%=48%
Ví dụ 2: Một loại phân có thành phần chính là KNO3 ( K=39; N=14; O=16 )
Xác định: %mK = ? ; %mN = ? ; %mO = ?
Giải:
+ Khối lượng Mol (M) của hợp chất : MKNO3= 39+14+(3.16)= 101g
+ Trong 1 mol KNO3: có 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O
( Hay trong 101g KNO3: có 39 g K; 14 g N và 3. 16 g O)
+ Tìm thành phần phần trăm các nguyên tố có trong hợp chất
%mO ≈ 100%-(38,6%+13,8%)= 47,6%
Tính theo phương trình hóa học
Để giải được các dạng bài tập tính theo phương trình Hóa học lớp 8 học sinh cần phải nắm vững các bước thực hiện sau:
Bước 1: Chuyển đổi số liệu về số mol
Bước 2: Lập PTHH
Bước 3: Xác định tỉ lệ trên Phương trình
Bước 4: Tính toán
Ví dụ 3: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO.
a. Lập PTHH.
b.Tính khối lượng ZnO thu được?
c.Tính thể tích oxi đã dùng? (đktc).
Lời giải
– Số mol Zn tham gia phản ứng.
a. PTHH: 2Zn + O2 2ZnO
2mol 1mol 2mol
0,2mol ? mol ? mol
b. Số mol ZnO tạo thành:
Khối lượng ZnO thu được:
mZnO = 0,2 . 81 = 16,2g.
Hi vọng với những bí quyết được cô Phạm Thị Thúy Ngọc chia sẻ các bạn học sinh sẽ không bị “mất gốc” và đạt kết quả học tập tốt đối với môn Hóa học 8. Phụ huynh và học sinh cũng có thể tham khảo Chương trình Học tốt 2020 – 2021 môn Hóa học của HOCMAI. Đây là khóa học bao gồm hệ thống bài giảng được thiết kế theo chương trình sách giáo khoa hiện hành do Bộ GD&ĐT ban hành cùng với đội ngũ giáo viên nhiều năm kinh nghiệm, sáng tạo và linh hoạt sẽ giúp học sinh không bỡ ngỡ trước những môn học mới.
 https://hocmai.link/blog-hoa-lop8
https://hocmai.link/blog-hoa-lop8
>> Phụ huynh điền thông tin để nhận tư vấn và học thử miễn phí Chương trình học tốt TẠI ĐÂY.
Đăng ký chương trình Học Tốt 2021 – 2022
Thông tin chi tiết về khóa học, phụ huynh và học sinh hãy gọi ngay hotline 0936 5858 12 để được tư vấn miễn phí. |