Đề cương ôn thi học kì 1 KHTN lớp 7 theo chương trình mới được HOCMAI biên soạn đầy đủ theo ba bộ sách mới bao gồm Kết nối tri thức, Cánh Diều và Chân trời sáng tạo. Các em học sinh khối 7 hãy tham khảo thật kỹ để chuẩn bị tốt nhất cho kỳ thi cuối HK1 sắp tới nhé!
⇒ Tham khảo thêm:
- Đề cương ôn thi học kì 1 ngữ văn 7
- Đề cương ôn thi toán lớp 7 học kì 1
- Đề cương Ôn thi học kì 1 lớp 7 môn tiếng anh
- Đề cương Ôn thi học kì 1 môn Lý lớp 7
- Đề cương Ôn thi học kì 1 môn Sinh lớp 7
A. KIẾN THỨC TRỌNG TÂM | ĐỀ CƯƠNG ÔN THI HỌC KÌ 1 KHTN LỚP 7 THEO CHƯƠNG TRÌNH MỚI
I. NGUYÊN TỬ – NGUYÊN TỐ HÓA HỌC – SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
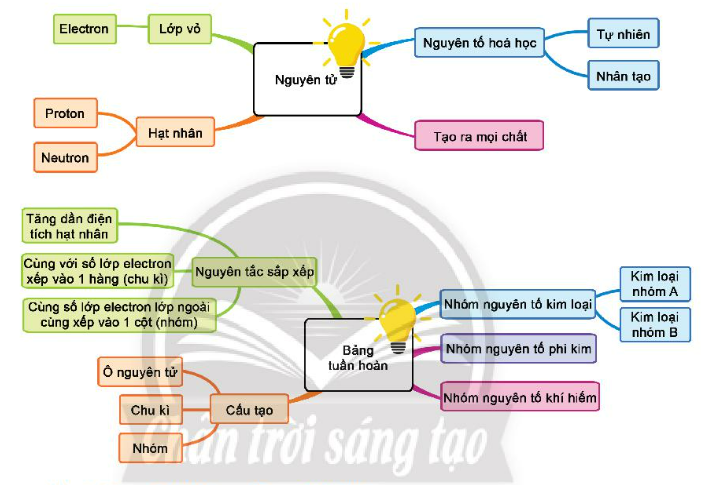
1. Nguyên tử
– Nguyên tử là những hạt cực kỳ nhỏ bé, không mang điện, cấu tạo nên chất.
– Cấu tạo nguyên tử bao gồm:
+) Vỏ nguyên tử gồm một hay nhiều electron mang điện tích âm (-). Mỗi hạt electron mang điện tích -1.
+) Hạt nhân của nguyên tử mang điện tích dương (+), được tạo bởi các proton (p) mang điện tích dương (+) và neutron (n) không mang điện.
- Mỗi hạt proton mang điện tích +1.
- Điện tích hạt nhân nguyên tử bằng tổng điện tích các proton.
- Số đơn vị điện tích hạt nhân bằng số proton.
– Nguyên tử trung hòa về điện ⇒ số proton (p) = số electron (e).
– Theo mô hình Rơ-dơ-pho-Bo, trong nguyên tử, electron phân bố ở trên các lớp electron và chuyển động xung quanh hạt nhân nguyên tử trên những quỹ đạo xác định.
- Electron phân bố ở trên các lớp electron theo chiều từ gần hạt nhân ra bên ngoài.
- Số electron tối đa ở trên mỗi lớp được xác định, như lớp thứ nhất có tối đa là 2 electron, từ lớp thứ hai có tối đa là 8 electron,…
– Khối lượng nguyên tử được coi bằng tổng khối lượng của proton (p) và neutron (n) có trong nguyên tử, tính bằng đơn vị amu.
2. Nguyên tố hóa học
– Nguyên tố hoá học là tập hợp các nguyên tử có cùng số proton (p) trong hạt nhân.
- Nguyên tố hóa học đặc trưng bởi số proton (p) trong nguyên tử.
- Các nguyên tử của cùng một nguyên tố đều sẽ có chung tính chất hóa học.
- Cho đến nay, Liên minh Quốc tế về Hóa học thuần túy và Hóa học ứng dụng (IUPAC) công bố đã tìm thấy 118 nguyên tố hóa học bao gồm: 90 nguyên tố ở trong tự nhiên; Số còn lại do con người tổng hợp nên, được gọi là nguyên tố nhân tạo.
– Mỗi nguyên tố hoá học đều có tên gọi và kí hiệu hoá học riêng.
– Kí hiệu hoá học của một nguyên tố được biểu diễn bằng một hoặc hai chữ cái trong tên nguyên tố; trong đó, chữ cái đầu tiên sẽ được viết ở dạng chữ in hoa, chữ cái thứ hai (nếu có) sẽ được viết ở dạng chữ thường.
3. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
– Các nguyên tố hoá học ở trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. Các nguyên tố cùng chu kì thì có cùng số lớp electron. Các nguyên tố cùng nhóm thì có tính chất hoá học tương tự nhau.
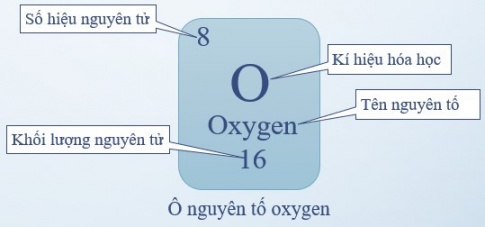
– Bảng tuần hoàn bao gồm các nguyên tố hoá học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm.
- Ô nguyên tố là một ô ở trong bảng tuần hoàn tương ứng với một nguyên tố hóa học. Ô nguyên tố cho ta biết: Số hiệu nguyên tử, tên nguyên tố, kí hiệu hóa học, khối lượng nguyên tử.
- Số hiệu nguyên tử (kí hiệu Z) = số đơn vị điện tích hạt nhân (= số proton (p) và = số electron (e)) và là số thứ tự của nguyên tố
Ví dụ: Ô nguyên tố oxygen
– Chu kỳ gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron (e) và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân. Số thứ tự của chu kì bằng với số lớp electron của nguyên tố.
– Nhóm gồm có các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân. Số thứ tự của nhóm A bằng với số electron lớp ngoài cùng.
– Bảng tuần hoàn cho ta biết: Các thông tin của nguyên tố; vị trí các nguyên tố; nguyên tố đó là kim loại, phi kim hay là khí hiếm.
- Các nguyên tố kim loại: (chiếm hơn 80% bảng tuần hoàn), nằm ở bên góc trái và góc dưới phía bên phải của bảng tuần hoàn ⇒ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (ngoại trừ hydrogen và boron).
- Các nguyên tố phi kim: Nằm ở phía trên, phía bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm phía trên ⇒ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
- Các nguyên tố khí hiếm: Là nguyên tố nằm ở trong nhóm VIIIA.
II. PHÂN TỬ
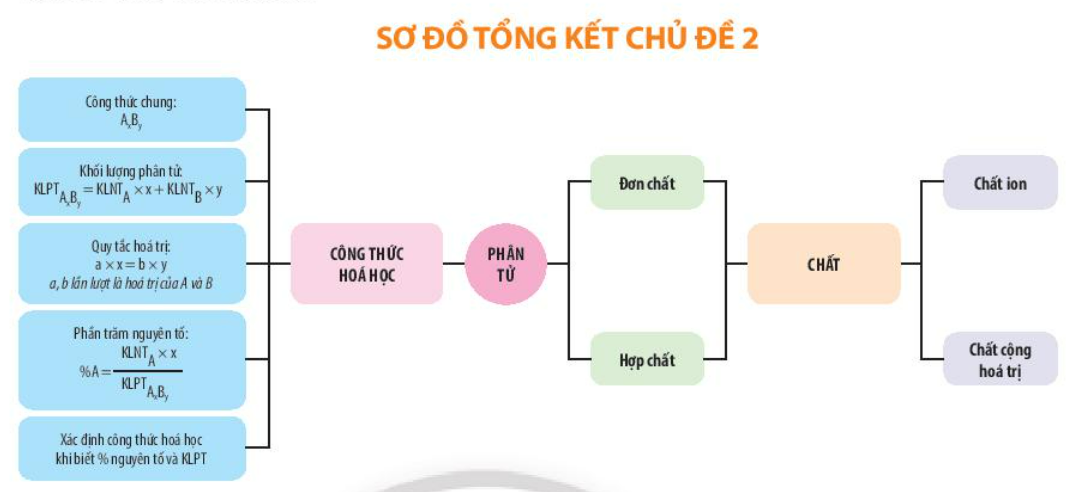
1. Đơn chất – Hợp chất – Phân tử
– Phân tử là hạt đại diện cho chất, bao gồm một số nguyên tử kết hợp cùng với nhau và thể hiện đầy đủ các tính chất hoá học của chất. Khối lượng phân tử bằng tổng khối lượng của các nguyên tử có ở trong phân tử
– Đơn chất được tạo nên bởi một nguyên tố hoá học.
– Hợp chất được tạo nên bởi hai hoặc nhiều nguyên tố hoá học.
2. Liên kết hóa học
– Đặc điểm cấu tạo vỏ nguyên tử khí hiếm: Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium lớp ngoài cùng sẽ chỉ có 2 electron.
– Liên kết ion là liên kết giữa ion âm và ion dương. Những ion dương và ion âm đơn nguyên tử có lớp electron ở phía ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
– Liên kết cộng hoá trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử. Liên kết cộng hoá trị thường là liên kết giữa 2 nguyên tử của nguyên tố phi kim
– Chất ion được tạo bởi những ion dương và ion âm.
- Chất ion thường ở thể rắn ở điều kiện thường.
- Chất ion khó nóng chảy, khó bay hơi, khi tan trong nước tạo ra dung dịch dẫn được điện.
– Chất cộng hóa trị là chất được tạo thành bởi liên kết cộng hoá trị.
- Chất cộng hóa trị có thể ở thể rắn, lỏng hoặc khí ở điều kiện thường.
- Chất cộng hoá trị kém bền với nhiệt, thường dễ bay hơi; một số chất tan được ở trong nước thành dung dịch. Tuỳ thuộc vào chất cộng hoá trị khi tan ở trong nước mà dung dịch thu được có thể dẫn hoặc không dẫn điện.
3. Hóa trị và công thức hóa trị hóa học
– Hóa trị:
- Hóa trị của một nguyên tố ở trong hợp chất là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó cùng với nguyên tử khác trong phân tử.
- Quy tắc hoá trị: Trong phân tử hợp chất 2 nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng với tích hóa trị và số nguyên tử của nguyên tố kia.
– Công thức hoá học:
- Công thức hoá học được dùng để biểu diễn chất, gồm một hoặc nhiều kí hiệu nguyên tố và chỉ số phía dưới, bên phải kí hiệu.
- Công thức tổng quát của phân tử có dạng:
- Công thức hoá học cho biết: Thành phần nguyên tố, khối lượng phân tử, số lượng nguyên tử của mỗi nguyên tố có trong phần tử đó, Tính phần trăm nguyên tố ở trong hợp chất
4. Hợp chất A B
– Xác định công thức hóa học:
+) Dựa vào khối lượng phân tử và phần trăm nguyên tố
- Bước 1: Đặt công thức hoá học cần phải tìm công thức tổng quát
- Bước 2: Lập biểu thức tính phần trăm của nguyên tố có trong hợp chất
- Bước 3: Xác định số nguyên tử của các nguyên tố và viết công thức hoá học cần tìm
+) Dựa vào quy tắc hóa trị
- Bước 1: Đặt công thức hoá học cần phải tìm (công thức tổng quát)
- Bước 2: Lập biểu thức dựa vào quy tắc hoá trị, chuyển thành tỉ lệ những chỉ số nguyên tử
- Bước 3: Xác định số nguyên tử (các số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hoá học cần phải tìm.
III. TỐC ĐỘ
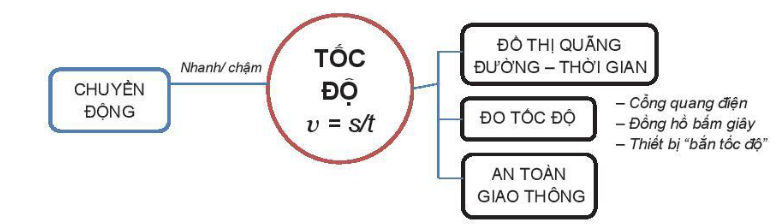
1. Tốc độ
– Tốc độ cho ta biết một vật chuyển động nhanh hay là chậm.
- Đơn vị đo tốc độ: m/s và km/h.
- Công thức tính tốc độ: v = s/t
– Một số đơn vị của quãng đường (s), thời gian (t) và tốc độ (v)
|
s |
m | km | km | m |
|
t |
s | h | phút | phút |
| v | m/s | km/h | km/phút |
m/phút |
– Đo tốc độ
- Bằng đồng hồ bấm giây
- Bằng đồng hồ đo thời gian có hiện số và cổng quang điện
- Thiết bị “bắn tốc độ”: Thường được sử dụng để xác định tốc độ của những phương tiện giao thông đường bộ.
– Tốc độ và an toàn giao thông:
- Tuân thủ Luật Giao thông đường bộ
- Điều khiển phương tiện trong giới hạn tốc độ cho phép để giữ an toàn cho bản thân và cho những người khác.
2. Đồ thị quãng đường thời gian
– Đồ thị quãng đường – thời gian mô tả nên liên hệ giữa quãng đường đi được của vật và thời gian để vật đi hết quãng đường đó
– Vận dụng đồ thị quãng đường – thời gian: Từ đồ thị quãng đường – thời gian cho trước, ta có thể tìm được quãng đường vật đi (hoặc tốc độ, thời gian chuyển động của vật).
IV. ÂM THANH
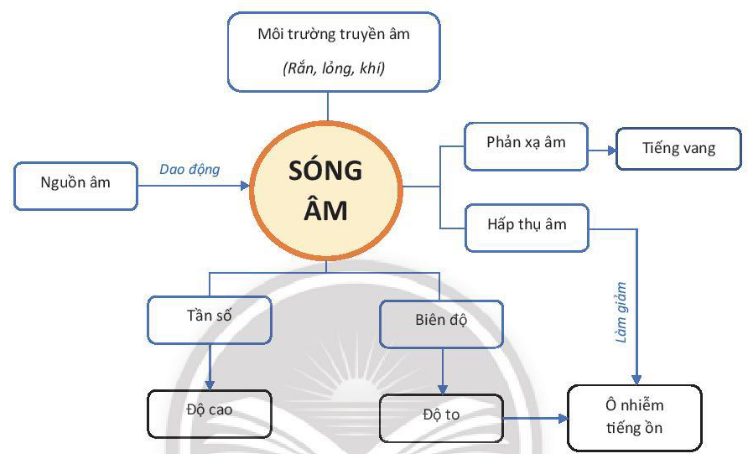
1. Sóng âm
– Sóng âm (âm) được phát ra từ các vật đang dao động.
– Môi trường truyền âm: Sóng âm truyền được ở trong các môi trường, rắn, lỏng khí.
– Sự truyền sóng âm ở trong không khí: Sóng âm ở trong không khí được lan truyền bởi sự dao động (dãn hoặc nén) của lớp không khí.
2. Độ cao và độ to của âm
– Biên độ và độ to của âm:
- Biên độ là độ lệch lớn nhất của vật dao động khi so với vị trí cân bằng của nó.
- Biên độ dao động của vật nếu phát ra âm càng lớn ⇒ âm càng to.
– Tần số và độ cao của âm:
- Tần số là số dao động trong 01 giây. Đơn vị: Hz
- Tần số của dao động càng lớn ⇒ âm càng cao (càng bổng).
- Tần số của dao động càng nhỏ ⇒ âm càng thấp (càng trầm).
3. Phản xạ âm – Chống ô nhiễm tiếng ồn
– Sóng âm phản xạ lại khi gặp vật cản. Các vật cứng, có bề mặt nhẵn thì phản xạ âm tốt. Ngược lại, những vật mềm, xốp, có bề mặt gồ ghề thì phản xạ âm kém.
– Tiếng vang hình thành khi âm phản xạ nghe được chậm hơn so với âm truyền trực tiếp đến tai ít nhất là 1/15 giây.
– Ô nhiễm tiếng ồn xảy ra lúc tiếng ồn to và kéo dài, gây ảnh hưởng xấu tới sức khoẻ và hoạt động của con người.
– Các biện pháp chống ô nhiễm tiếng ồn là: Ngăn chặn sự truyền âm; tác động vào nguồn âm, phân tán âm trên đường truyền,…
V. Ánh sáng
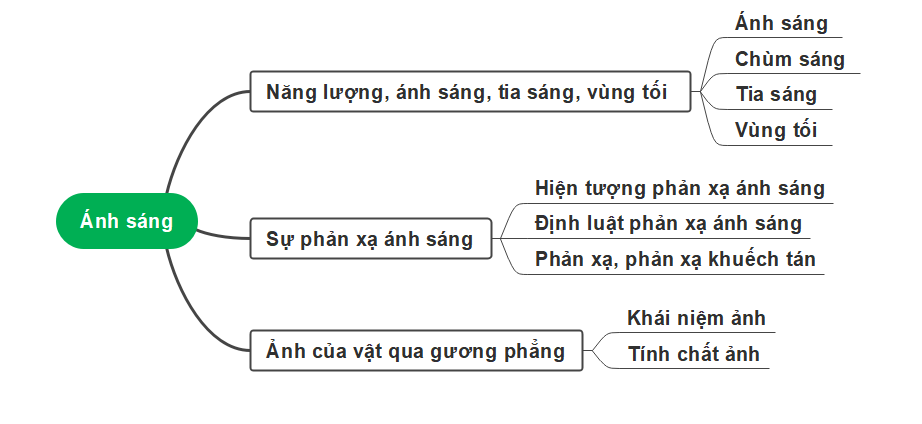
1. Ánh sáng, tia sáng
– Ánh sáng là một dạng của năng lượng. Nó có thể thu được bằng nhiều cách khác nhau.
– Tia sáng là đường truyền của ánh sáng được biểu diễn bởi một đường thẳng có mũi tên chỉ hướng. Một chùm sáng hẹp song song có thể được xem là một tia sáng.
– Vùng tối là vùng nằm phía sau vật cản sáng, hoàn toàn không nhận được ánh sáng bởi nguồn sáng truyền tới.
– Vùng nửa tối là vùng nằm phía sau vật cản sáng, nhận được một phần ánh sáng bởi nguồn sáng truyền tới.
2. Sự phản xạ ánh sáng
– Sự phản xạ ánh sáng ở trên bề mặt các vật:
- Các vật có bề mặt nhẵn bóng ⇒ Gọi là sự phản xạ.
- Các vật có bề mặt không nhẵn bóng ⇒ Gọi là phản xạ khuếch tán.
– Định luật phản xạ ánh sáng: Tia phản xạ nằm bên trong mặt phẳng chứa tia tới và pháp tuyến của gương tại điểm tới; góc phản xạ bằng với góc tới.
3. Ảnh của vật qua gương phẳng
– Ảnh của vật được tạo bởi gương phẳng là ảnh ảo, không hứng được ở trên màn chắn, có độ lớn bằng với vật. Khoảng cách từ ảnh đến gương phẳng bằng khoảng cách từ vật tới gương phẳng.
– Các tia sáng từ điểm sáng S đến gương phẳng cho tia sáng phản xạ có đường kéo dài đi qua ảnh ảo S. Chúng ta nhìn thấy ảnh ảo S của điểm sáng S khi các tia sáng phản xạ lọt vào trong mắt có đường kéo dài đi qua ảnh S.
– Tập hợp ảnh của tất cả các điểm trên vật là ảnh của một vật sáng.
II – ĐỀ ÔN THI HỌC KÌ 1 KHTN LỚP 7 CÁNH DIỀU | CHÂN TRỜI SÁNG TẠO | KẾT NỐI TRI THỨC
Sau khi ôn luyện lại toàn bộ kiến thức trọng tâm đã học, các em học sinh hãy luyện tập với các đề thi để nắm chắc cũng như làm quen cùng với ma trận đề thi. HOCMAI đã tổng hợp đầy đủ 3 bộ đề thi cuối HK1 Khoa Học Tự Nhiên lớp 7 theo 3 bộ sách mới là Chân trời sáng tạo, Cánh Diều và Kết nối tri thức với cuộc sống.
Tham khảo Đề thi học kì 1 KHTN lớp 7 Cánh Diều (Có hướng dẫn giải chi tiết) tại đây:
Tham khảo Đề thi học kì 1 KHTN lớp 7 Kết nối tri thức (Có hướng dẫn giải chi tiết) tại đây:
Tham khảo Đề thi học kì 1 KHTN lớp 7 Chân trời sáng tạo (Có hướng dẫn giải chi tiết) tại đây:
Trên đây là Đề cương ôn thi học kì 1 KHTN lớp 7 theo ba bộ sách chương trình mới là Kết nối tri thức, Cánh Diều và Chân trời sáng tạo do HOCMAI biên soạn. Hy vọng với những kiến thức HOCMAI được tổng hợp cũng như các bộ đề thi ôn luyện trong bài, các em sẽ nắm chắc kiến thức để sẵn sàng cho kỳ thi chính thức.



















