Các em học sinh khối 8 thân mến, từ năm nay các em sẽ bắt đầu được học môn Hóa học. Đây quả thật là một môn học rất thú vị và bổ ích. Tuy vậy, HOCMAI biết rằng các em ban đầu sẽ rất bỡ ngỡ và có thể cảm thấy khó tiếp thu. Kì thi giữa học kì 1 là kì thi lớn đầu tiên của các em. Nếu các em không biết phải ôn bắt đầu từ đâu, và làm bài như thế nào thì bài viết này là dành cho các em đấy. Bây giờ chúng ta cùng bài đề cương ôn thi giữa kì 1 Hóa học 8 nhé các em!
Bài viết các em có thể tham khảo thêm trong quá trình học:
Phương pháp học tốt môn Hóa học – khối 8
A. LÝ THUYẾT ÔN THI GIỮA KỲ I HÓA HỌC 8
1. Khái niệm về nguyên tử, phân tử, nguyên tử khối, phân tử khối.
- Nguyên tử là loại hạt vô cùng nhỏ và mang tính trung hòa về điện. Nguyên tử bao gồm hạt nhân bên trong mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm:
- Hạt nhân được tạo nên bởi proton (kí hiệu :p) và nơtron
- Trong mỗi nguyên tử: p(+) = e(-)
- Electron luôn luôn chuyển động quanh hạt nhân và electron sắp xếp thành từng lớp.
- Nguyên tố hóa học là một tập hợp những nguyên tử cùng loại, có cùng số proton trong cùng một hạt nhân.
- Kí hiệu hóa học có chức vụ biểu diễn một nguyên tử trong một nguyên tố.
Nguyên tử khối là khối lượng của một nguyên tử được tính bằng đơn vị là cacbon. Mỗi nguyên tố thì có nguyên tử khối riêng biệt nhau.
- Phân tử là một loại hạt đại diện cho chất, gồm một số nguyên tử được liên kết với nhau và nó thể hiện đầy đủ toàn bộ tính chất hóa học của chất.
- Phân tử là loại hạt cấu thành của hầu hết các chất và các đơn chất kim loại… có hạt hợp thành là nguyên tử.
- Phân tử khối là khối lượng của một phân tử và đã được tính bằng đơn vị: cacbon, phân tử khối thì bằng tổng những nguyên tử khối của các nguyên tử trong phân tử đó.
2. Thế nào là đơn chất, hợp chất. Cho ví dụ?
- Đơn chất: là những chất được cấu tạo nên từ một nguyên tố hóa học. Ví dụ: natri,loại khí hiđro, kẽm, lưu huỳnh,…
- Hợp chất: là những chất được cấu tạo nên từ hai hoặc nhiều nguyên tố hóa học khác nhau. Ví dụ: Nước (H2O) tạo nên từ hai nguyên tố hóa học là H và O.
3. Công thức hóa học dùng để biểu diễn chất
- Đơn chất: A (đơn chất kim loại và một vài đơn chất phi kim loại, như: S,C)
- Đơn chất: Ax (phần lớn là đơn chất phi kim loại, thường x = 2)
- Hợp chất: AxBy, AxByCz…
Mỗi công thức hóa học thì chỉ một phân tử của chất (ngoại trừ đơn chất A) và cho biết:
- Nguyên tố tạo nên chất.
- Phân tử khối, số lượng nguyên tử của mỗi nguyên tố.
4. Phát biểu quy tắc hóa trị – Viết biểu thức.
Nhóm nguyên tử hay còn gọi là hóa trị của nguyên tố là những con số có chức năng biểu thị khả năng liên kết của những nguyên tử (hoặc gọi là nhóm nguyên tử), nó được xác định bằng hóa trị của H chọn thì làm một đơn vị và hóa trị của O thì là hai đơn vị.
Quy tắc hóa trị: Trong một công thức hóa học, ta có tích của hóa trị và chỉ số của nguyên tố này bằng tích của hóa trị và chỉ số của nguyên tố kia.
Biểu thức: a × x = b × y. B có thể là nhóm nguyên tử, ví dụ: Ca(OH)2, ta có I × 2 = II × 1
5. Sự biến đổi của chất
- Hiện tượng vật lý là kiểu hiện tượng mà khi chất biến đổi nhưng vẫn giữ nguyên là chất ban đầu.
- Hiện tượng hóa học là kiểu hiện tượng mà khi chất biến đổi có tạo ra chất khác.
6. Phản ứng hóa học
- Phản ứng hóa học là một quá trình chất này biến đổi sang chất khác.
- Trong một phản ứng hóa học, chỉ có thể liên kết giữa các nguyên tử thay đổi thì làm cho từ phân tử này biến đổi thành phân tử khác.
- Phản ứng sẽ được xảy ra được khi các chất tham gia được tiếp xúc với nhau, có trường hợp cần chất xúc tác, có trường hợp cần tác động nhiệt.
- Để nhận biết phản ứng xảy ra phải dựa vào dấu hiệu có chất mới tạo thành: Có sự thay đổi về trạng thái, màu sắc, nhiệt lượng hoặc phát sáng.
B. BÀI TẬP ÔN THI GIỮA KỲ I HÓA HỌC 9
Phần 1: Trắc nghiệm
Câu 1: Dãy chất nào bên dưới đều là những hỗn hợp:
A) Không khí, khí oxi và nước mưa
B) Khí hidro, nước cất và thủy tinh
C) Khí cacbonic, nước ngọt và cà phê sữa
D) Nước đường, nước muối và sữa
Câu 2: Hạt nhân thì được cấu tạo nên bởi:
A) Electron và notron
B) Electron và proton
C) Nơtron và proton
D) Chỉ electron
Câu 3: Cho nguyên tố O có khối lượng nguyên tử là 16, Mg có khối lượng nguyên tử là 24. Nguyên tử nào thì nặng hơn?
A) Mg nặng hơn nguyên tử O
B) Mg nhẹ hơn nguyên tử O
C) Nguyên tử O bằng Mg
D) Đáp án khác
Câu 4: Nguyên tố nào là phổ biến nhất trên hành tinh Trái Đất?
A) Cacbon (than)
B) Oxi
C) Sắt
D) Silic
Câu 5: Cho nguyên tố R có số lượng nguyên tử là 12 proton. Chọn đáp án đúng?
A) R là nguyên tố Mg
B) Nguyên tử khối của R là 12
C) Số electron là 24
D) Có 12 nguyên tử
Câu 6: Chọn đáp án sai trong những đáp án bên dưới đây:
A) Cacbon đioxit được cấu tạo nên từ 2 nguyên tố O và 1 nguyên tố C
B) Nước là một loại hợp chất
C) Muối ăn thì không chứa thành phần clo
D) Có 2 loại hợp chất là hợp chất vô cơ và hợp chất hữu cơ
Câu 7: Trong những dãy nhất dưới đây, dãy chất nào hoàn toàn là kim loại?
A) Canxi, sắt, photpho, lưu huỳnh
B) Đồng, lưu huỳnh, thủy ngân, bạc
C) Bạc, sắt, kẽm, đồng
D) Sắt, nhôm, bạc, cacbon
Câu 8: Nguyên tố X có khối lượng nguyên tử bằng 6,75 lần khối lượng nguyên tử của oxi. X là nguyên tố nào sau đây
A) Fe
B) Cu
C) Ag
D) Hg
Câu 9: Cho nguyên tố X có hóa trị III, công thức hóa học nào dưới đây đúng với hợp chất tạo bởi nguyên tố X và nhóm chất (CO3) là:
A) X2(CO3)3
B) XCO3
C) X2CO3
D) X(CO3)3
Câu 10: Cho các chất có công thức hóa học như sau đây: Cu, KHCO3, Al(OH)3, NaClO3, N2. Số đơn chất là:
A) 1
B) 2
C) 3
D) 4
Câu 11: Cho phân tử M2O nặng gấp phân tử Hiđro 47 lần. Vậy, nguyên tử khối của M bằng:
A) 23
B) 39
C) 40
D) 24
Câu 12: Nguyên tố Natri (Na) là một tập hợp nhiều nguyên tử có cùng
A) 11 hạt nhân
B) 6 hạt electron
C) 6 hạt proton
D) 11 hạt proton
Câu 13: Trong các chất sau đây, hãy cho biết dãy nào chỉ gồm toàn đơn chất?
A) Fe(NO3)2, NO, C, S
B) Mg, K, S, C, N2
C) Fe, NO2, H2O
D) Cu(NO3)2, KCl, HCl
Câu 14: Phân tử khối của CH4, KCl, Mg(OH)2 lần lượt là:
A) 16 đvC, 58 đvC, 74,5 đvC
B) 74,5 đvC, 16 đvC, 58 đvC
C) 17 đvC, 74,5 đvC, 58 đvC
D) 16 đvC, 74,5 đvC, 58 đvC
Câu 15: Từ công thức hóa học của CuSO4 , ta có thể suy ra được những gì?
A) 3 nguyên tố Cu, O, S tạo nên CuSO4
B) Trong phân tử có 3 nguyên tử oxi
C) Phân tử khối là 96 đvC
D) Tất cả đáp án
Câu 16: Cho kim loại M để tạo ra được hợp chất MSO4. Biết phân tử khối là 120. Xác định kim loại M
A) Magie
B) Đồng
C) Sắt
D) Bạc
Câu 17: Cho công thức hoá học của sắt có hóa trị III oxit là Fe2O3, hiđro clorua là HCl. Công thức hóa học đúng của sắt (III) clorua là:
A) FeCl2.
B) FeCl.
C) FeCl3.
D) 2Cl
Câu 18: Cho S có hóa trị là IV, chọn công thức hóa học đúng trong các công thức hóa học sau:
A) SO2.
B) S2O3.
C) S2O2.
D) SO3
Câu 19: Lập công thức hoá học của hai hợp chất sau biết rằng P(V) và O
A) P2O5.
B) P2O3.
C) P2O4.
D) PO4.
Câu 20: Cặp chất nào dưới đây thì có cùng phân tử khối?
A) N2 và CH4
B) C2H4 và N2
C) CO2 và C26
D) CO và C2H2
Câu 21: Cho nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 28, trong đó số hạt không mang điện chiếm 35,7%. Số hạt proton và hạt notron trong X lần lượt sẽ là:
A) 9 và 10
B) 10 và 8
C) 10 và 9
D) 8 và 12
Câu 22: Cho hợp chất AgxPO4, biết rằng Ag hóa trị I. Giá trị x là
A) 1
B) 2
C) 3
D) 4
Câu 23: Cho một nguyên tử có tổng số hạt là 52, số proton trong đó là 17. Vậy số electron và số nơtron lần lượt sẽ là :
A) 18 và 17
B) 19 và 16
C) 16 và 19
D) 17 và 18
Câu 24: Chọn công thức hóa học đúng của hợp chất tạo bởi Ca và PO4
A) Ca2PO4
B) CaPO4
C) Ca3(PO4)2
D) Ca(PO4)2
Câu 25: Trong hợp chất của nguyên tố M hóa trị II trong đó nguyên tố oxi chiếm 80% về khối lượng trong hợp chất. Nguyên tố M là:
A) Al
B) Zn
C) Cu
D) Ca
Phần 2: Tự luận
Câu 26: Hãy lập công thức hóa học (CTHH) và tính khối lượng phân tử của các hợp chất sau:
a) Axit photphoric có lượng phân tử gồm 3H, 4O, 1P liên kết với nhau.
b) Đường saccarozơ có lượng phân tử gồm 12C, 11O và 22H liên kết với nhau.
Câu 27: Một hợp chất khí X có khối lượng phân tử là 58 đvC, được cấu tạo nên từ hai nguyên tố C và H. Biết trong X, chiếm 82,76% khối lượng là nguyên tố C. Em hãy tìm công thức hóa học của hợp chất khí Y
Câu 28: Em hãy lập công thức hóa học (CTHH) và tính khối lượng phân tử của các hợp chất được tạo bởi một nguyên tố cùng với nhóm nguyên tử sau: nhóm (SO4) và Fe (III)
Câu 29:
a) Xác định hóa trị của N trong hợp chất N2O5
b) Lập công thức hóa học của hợp chất gồm có Ba (II) và nhóm PO4 (III)
Câu 30: Một hợp chất A có phân tử gồm 1 nguyên tử X và 3 nguyên tử Y. Tỷ lệ khối lượng của X và Y là mx:my = 2:3. Phân tử khối của hợp chất A là 80 đvC. Hãy xác định công thức hóa học (CTHH) của hợp chất A.
Đáp án và bài giải:
| 1. D | 2. C | 3. A | 4. B | 5. A |
| 6. A | 7. C | 8. C | 9. A | 10. B |
| 11. B | 12. D | 13. B | 14. D | 15. A |
| 16. A | 17. C | 18. A | 19. A | 20. B |
| 21. A | 22. C | 23. D | 24. C | 25. C |
Câu 26:
- a) H3PO4
Phân tử khối của H3PO4 = 3.1 + 31 + 16.4 = 98 đvC
- b) C12H22O11
Phân tử khối của C12H22O11 = 12.12 + 22 + 16.11 = 342 đvC
Câu 27:
Gọi công thức hóa học (CTHH) của chất khí Y có dạng CxHy (x,y: nguyên dương)
Phần trăm của khối lượng nguyên tố C bên trong CxHy bằng:
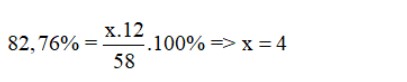
Phân tử khối của CxHy = x.C + y.H = 58 (đvC)
⇒ 4.12 + y.1 = 58 ⇒ y = 10
Vậy công thức hóa học của hợp chất khí trên là: C4H10
Câu 28:
Công thức hóa học của hợp chất có dạng: Fex(SO4)y
Ta có:
x.III = y.II => x/y = II/III = 2/3 => x = 2; y = 3
Công thức hóa học của hợp chất là Fe2(SO4)3
Phân tử khối = 2.56 + 32.3 + 16.4.3 = 400 đvC
Câu 29:
- a) Nitơ trong N2O5
Gọi hóa trị của Nitơ trong hợp chất là x:
Ta có hóa trị của O (II)
Theo quy tắc hóa trị.
- x = 5.II ⇒ x = 5 (V) . Vậy N có hóa trị bằng V trong hợp chất N2O5
- b) Lập công thức hóa học của hợp chất gồm Ba (II) và nhóm PO4 (III)
Công thức hóa học dạng:

Theo quy tắc hóa trị: x.II = y.III, suy ra:
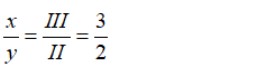
⇒ Chọn x = 3, y = 2
Vậy công thức hóa học là Ba3(PO4)2
Câu 30:
Phân tử A gồm 1 nguyên tử X và 3 nguyên tử Y ⇒ Công thức hóa học của A có dạng XY3
Phân tử khối của hợp chất A là 80 đvC ⇒ X + 3Y = 80 (1)
Tỉ lệ khối lượng của X và Y là 2 : 3 ⇒ X : 3Y = 2 : 3 (2)
X = 32 (đvC) ⇒ X là S
Y = 16 (đvC) ⇒ Y là O
Công thức hóa học của A là SO3
Bài viết tham khảo thêm:
- Đề cương ôn thi giữa kì 1 Vật lý 8
- Đề cương ôn thi giữa kì 1 Tiếng Anh 8
- Đề cương ôn thi giữa kì 1 Toán 8
Vậy là bài đề cương ôn thi giữa kì I hóa học 8 gồm đầy đủ lý thuyết, bài tập trắc nghiệm và bài tập tự luận đã kết thúc rồi. Môn hóa đúng quả thật rất mới và khó đối với các em học sinh. Vậy nên, các em cần phải cố gắng học hành chăm chỉ để nằm lòng kiến thức các em nhé.HOCMAI sẽ luôn ở đây hỗ trợ, và tiếp bước cho các em. Để tham khảo được thêm thật nhiều bài học quý quá và kiến thức bổ ích, các em hãy truy cập hoctot.hocmai.vn nhé!


















