Môn hóa học tuy rằng lên tới cấp Trung học Cơ sở các em học sinh mới được tiếp xúc, nhưng môn học này thực sự đóng vai trò rất quan trọng trong đời sống thường ngày của chúng ta. Việc nắm vững kiến thức hóa học không chỉ giúp các em hoàn thành tốt bài thi của mình mà các em có thể sử dụng những kiến thức ấy trong những tình huống khác nhau thực tiễn đời thường. Sau đây, HOCMAI gửi tới các em bài Ôn thi hóa lớp 9 học kì 1. Các em hãy cùng ôn tập với HOCMAI nhé!
Bài viết tham khảo thêm:
A. TỔNG QUAN ÔN TẬP ĐỀ THI HÓA LỚP 9 HỌC KÌ 1
I. Lý thuyết:
- Tính chất hóa học của những chất: oxit, axit, muối, bazơ, kim loại, phi kim.
- Tính chất hóa học của những chất: axit sunfuric đặc, nhôm, clo.
- Phân bón hóa học.
- Các biện pháp để phòng chống ăn mòn kim loại.
- Dãy hoạt động hóa học của những hợp chất kim loại và ý nghĩa của nó.
- Tính chất vật lý của CaO, NaOH, Al, SO2, H2SO4, Fe, Cl2.
- Điều chế: SO2 , NaOH, CaO, H2SO4, Al, Cl2.
- Ứng dụng của CaO, Al, NaCl, Fe (thép – gang)
- Điều kiện để phản ứng có thể xảy ra ở trong dung dịch.
Lưu ý học lại về tính tan và xem các hiện tượng xảy ra ở trong các thí nghiệm trong sách giáo khoa, màu sắc của các chất, các hợp chất, các dung dịch ta đã biết.
II. Các dạng bài tập:
– Viết các phương trình hóa học để minh họa cho tính chất hóa học, ứng dụng của các chất, phương trình hóa học để điều chế các chất.
– Dựa vào những tính chất hóa học, tính chất vật lý để giải thích những ứng dụng, những hiện tượng chúng ta thường gặp.
– Viết phương trình hóa học để hoàn thành những dãy chuyển hóa, thể hiện mối quan hệ tương quan giữa các loại hợp chất vô cơ.
– Phân biệt và nhận biết các chất bằng những phương pháp vật lý và hóa học.
– Các bài tập định lượng như sau:
- Áp dụng tính theo phương trình hóa học
- Tính nồng độ dung dịch
- Định luật bảo toàn khối lượng
- Tính khối lượng kết tủa
- Tính thành phần trong hỗn hợp ban đầu hoặc hỗn hợp sản phẩm, Tính thể tích chất khí (đktc)
- Xác định tên của nguyên tố,….
III. Phần mở rộng:
- Áp dụng những kiến thức mở rộng trong phần mục em có biết.
- Phản ứng giữa những chất: oxit axit với dung bazơ.
- Phản ứng giữa những chất: kim loại với axit sunfuric đặc nóng.
- Phản ứng giữa những chất: Al, Zn với dung dịch bazơ.
B. LÝ THUYẾT ĐỀ CƯƠNG ÔN THI HỌC KÌ 1 MÔN HÓA 9
I. OXIT
a) Định nghĩa: Oxit là một hợp chất gồm có 2 nguyên tố, trong đó thì có một nguyên tố là oxi.
Ví dụ: CaO, CO, Na2O, Fe3O4, SO2, P2O5, …
b) Tính chất hóa học:
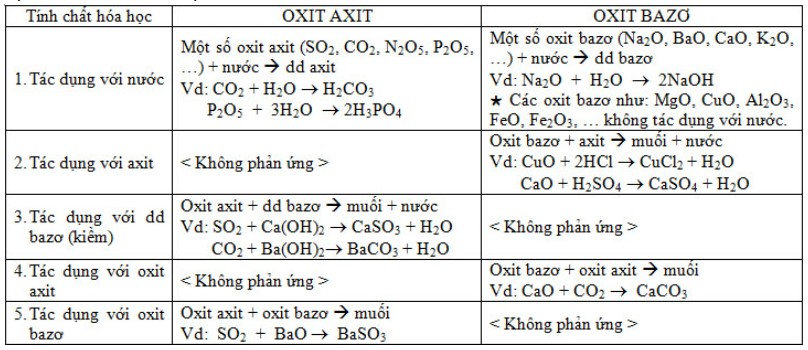
II. AXIT
a) Định nghĩa: Axit là một hợp chất mà phân tử gồm có một hoặc nhiều nguyên tử H được liên kết với gốc axit. Các nguyên tử H này thì có thể được thay thế bằng các nguyên tử kim loại.
Ví dụ: HCl, H2SO4, HNO3, H3PO4,…
b) Tính chất hóa học:
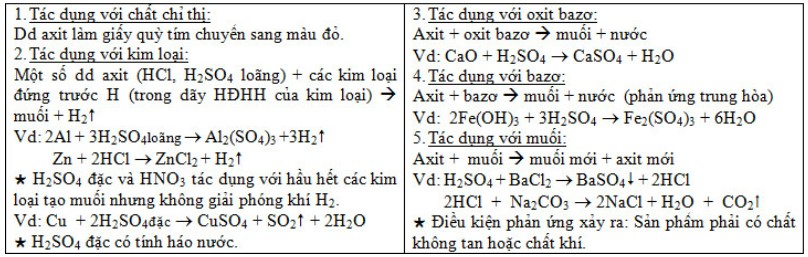
Sản xuất chất axit sunfuric: Gồm có các công đoạn như sau:
(1) S + O 2 t 0 ,V 2 O 5 → SO 2
(2) 2SO 2 + O 2 → 2SO 3
(3) SO 3 + H 2 O → H 2 SO 4
III. BAZƠ
a) Định nghĩa: Bazơ là một hợp chất mà phân tử của nó bao gồm có một nguyên tử kim loại liên kết được với một hoặc nhiều nhóm hidroxit (OH).
Ví dụ: KOH, Ba(OH)2, NaOH, Al(OH)3,…
b) Tính chất hóa học:
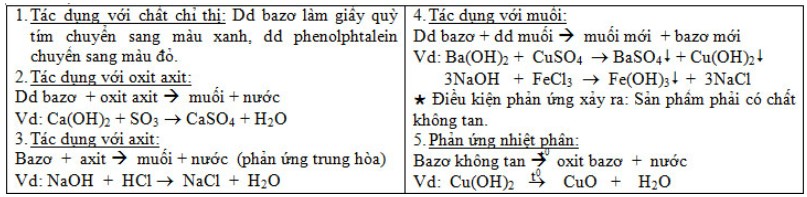
Sản xuất chất natri hiđroxit:
2NaCl + H2O điện phân dung dịch, có màng ngăn: → 2NaOH + Cl2 + H2
c) Thang pH: Được dùng để biểu thị độ bazơ (kiềm) hoặc độ axit của một dung dịch, cách tính như sau:
pH < 7: tính axit ; pH = 7: trung tính ; pH > 7: tính bazơ (kiềm)
IV. MUỐI
a) Định nghĩa: Muối là một hợp chất mà trong đó phân tử gồm có một hoặc nhiều nguyên tử kim loại liên kết với một hoặc nhiều gốc axit.
Ví dụ: NaCl, Fe(NO3)2, MgSO4, BaCO3, …
b) Tính chất hóa học:
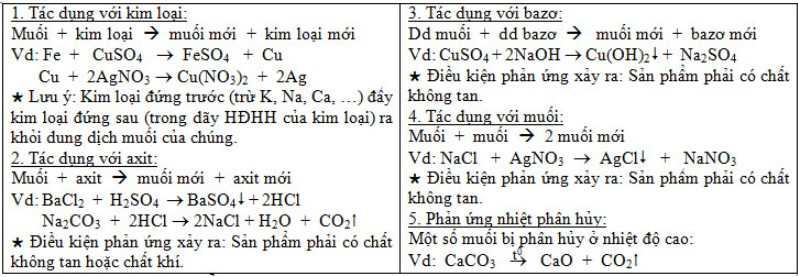
c) Phản ứng trao đổi:
Định nghĩa: Là một phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo nên chúng để tạo ra những hợp chất mới.
Ví dụ:
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Na 2 CO 3 + 2HCl → 2NaCl↓ + H 2 O + CO 2 ‹ ↑
CuSO 4 + 2NaOH → Cu(OH) 2↓ + Na 2 SO 4
NaCl + AgNO 3 → AgCl↓ + NaNO 3
Điều kiện để một phản ứng trao đổi có thể xảy ra là: Phản ứng trao đổi ở trong một dung dịch của các chất chỉ có thể xảy ra nếu sản phẩm được tạo thành có chứa chất khí hoặc chất không tan.
Lưu ý: Phản ứng trung hòa cũng là một phản ứng trao đổi và luôn luôn xảy ra.
Ví dụ: NaOH + HCl → NaCl + H2O
V. KIM LOẠI
1. TÍNH CHẤT CHUNG CỦA KIM LOẠI
a) Tính chất vật lý:
Dễ dát mỏng, có tính dẻo, và dễ kéo sợi.
Dẫn nhiệt cũng như dẫn điện tốt. (Ag – bạc là một kim loại có khả năng dẫn điện và dẫn nhiệt tốt nhất, tiếp theo sẽ là Cu – đồng, Al – nhôm, Fe – sắt, …)
Có ánh kim.
b) Tính chất hóa học:

SO SÁNH TÍNH CHẤT CỦA SẮT VÀ NHÔM:
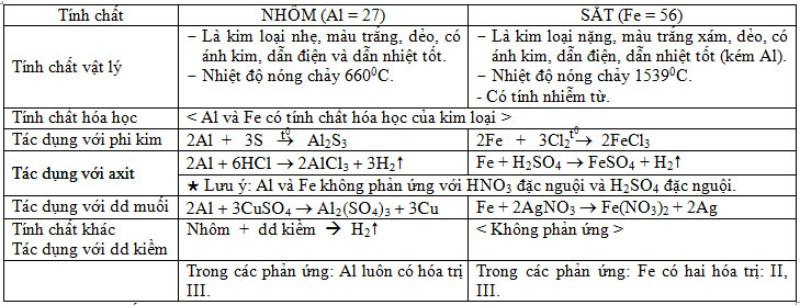
Sản xuất kim loại nhôm:
Nguyên liệu: quặng boxit (thành phần chủ yếu bên trong là Al2O3), than cốc và không khí.
Phương pháp sản xuất: điện phân nóng chảy.
2Al2O3 : Phương pháp điện phân nóng chảy, criolit → 4Al + 3O2
2. DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
Theo chiều giảm dần mức độ hoạt động của các kim loại:
K – Na – Ca – Mg – Al – Zn – Fe – Pb – (H) – Cu – Ag – Au
Ý nghĩa của dãy hoạt động hóa học của các kim loại:
Mức độ hoạt động hóa học của những kim loại giảm dần từ chiều trái sang phải.
Kim loại khi đứng trước chất Mg tác dụng với nước ở trong điều kiện thường là chất kiềm và khí hiđro.
Kim loại khi đứng trước chất H phản ứng với một số dung dịch axit (H2SO4 loãng, HCl,…) là khí H2.
Kim loại khi đứng trước (trừ K, Na…) đẩy những kim loại đứng sau ra khỏi dung dịch muối.
3. HỢP CHẤT SẮT: THÉP, GANG
a) Hợp kim: Là loại chất rắn thu được sau khi đã làm nguội hỗn hợp nóng chảy của rất nhiều kim loại khác nhau này hoặc hỗn hợp phi kim loại và kim loại.
b) Thành phần, tính chất và phương pháp sản xuất thép, gang:
| Hợp kim | BĂNG NHÓM | THÉP |
| Thành phần | Hàm lượng cacbon 2 – 5%; 1 – 3% các nguyên tố S, P, Si, Mn; còn lại là nguyên tố Fe. | Hàm lượng cacbon thấp dưới 2%; thấp dưới 0,8% các nguyên tố P, S, Mn; còn lại là nguyên tố Fe. |
| Tính chất | Giòn, không rèn được, không dát mỏng được. | Đàn hồi, dẻo (dát mỏng, rèn, kéo sợi được) và cứng. |
| Sản xuất | – Trong lò cao.
– Nguyên tắc: chất CO khử các oxit sắt ở nhiệt độ cao: 3CO + Fe2O3 → 3CO2 + 2Fe |
– Trong lò luyện thép.
– Nguyên tắc: Oxi hóa các nguyên tố Si, C, Mn, S, P, … có trong kim loại gang. FeO + C → Fe + CO |
VI. PHI KIM:
1. TÍNH CHẤT CHUNG CỦA PHI KIM
a) Tính chất vật lý:
Ở một điều kiện bình thường, chất phi kim tồn tại ở cả 3 trạng thái là: rắn (S, P, …) ; khí (Cl2, O2, N2, H2,…); lỏng (Br2).
Phần lớn thì các nguyên tố phi kim không có tính ánh kim; dẫn nhiệt, dẫn điện kém; Nhiệt độ nóng chảy không cao.
Một số phi kim thì độc như là: Cl2, Br2, I2.
b) Tính chất hóa học:
| 1. Tác dụng với kim loại: Nhiều phi kim + kim loại → muối:
Vd: 2Na + Cl 2 t 0 → 2NaCl Oxi + kim loại → oxit: Vd: 2Cu + O 2 → 2CuO 2. Tác dụng với hiđro: Oxi + khí hiđro → hơi nước 2H2 + O2 → 2H2O _ _ Clo + khí hidro → khí hidro clorua H 2 + Cl 2 → 2HCl Nhiều chất phi kim khác (Br2, C, S,…) khi phản ứng với chất khí hiđro sẽ tạo thành một hợp chất khí. |
3. Tác dụng với oxi: Nhiều phi kim + khí oxi → oxit axit
Vd: S + O 2 t 0 → SO 2 4P + 5O 2 t 0 → 2P 2 O 5 4. Mức độ hoạt động hóa học của chất/hợp chất phi kim: – Mức độ hoạt động hóa học yếu hay mạnh của phi kim thường được xét căn cứ vào mức độ phản ứng và khả năng phản ứng của phi kim đó với hiđro và kim loại. – Flo, clo, oxi là những chất phi kim hoạt động mạnh mẽ (trong đó flo là phi kim hoạt động mạnh nhất). – Lưu huỳnh, cacbon, silic, photpho là những chất phi kim hoạt động yếu hơn. |
2. SO SÁNH TÍNH CHẤT CỦA CLO VÀ CACBON
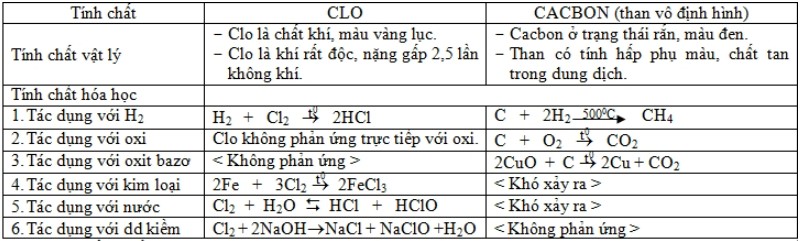
Điều chế Clo:
Trong phòng thí nghiệm: MnO2 + HClđặc → MnCl2 + Cl2 + H2O
Trong công nghiệp: 2NaCl + H2O Điện phân, có màng ngăn → 2NaOH + Cl2 + H2
3. CÁC OXIT CỦA CACBON
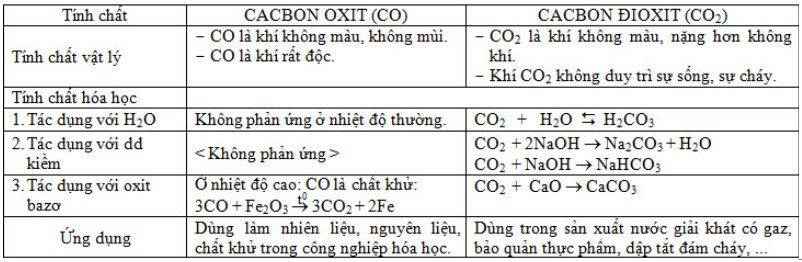
TÍNH TAN TRONG NƯỚC CỦA MỘT SỐ DUNG DỊCH BAZƠ, MUỐI:
| Bazơ tan | KOH, NaOH, Ba(OH)2, Ca(OH)2 ít tan. |
| Bazơ không tan | Mg(OH) 2 , Fe(OH) 3 , Zn(OH) 2 , Cu(OH) 2 , Fe(OH) 2 , Al(OH) 3 , Pb(OH) 2 |
| Muối Sunfat (=SO4) | Hầu hết tan (ngoại trừ hợp chất PbSO4, BaSO4 không tan). |
| Muối Sunfit (=SO3) | Hầu hết thì không tan (ngoại trừ Na2SO3, K2SO3 tan). |
| Muối Nitrat (-NO3) | Tất cả đều tan. |
| Muối Photphat (≡PO4) | Hầu hết thì không tan (ngoại trừ Na3PO4, K3PO4 tan ). |
| Muối Cacbonat (=CO3) | Hầu hết thì không tan (ngoại trừ Na2CO3, K2CO3 tan). |
| Muối Clorua (-Cl ) | Hầu hết thì đều tan (ngoại trừ AgCl là không tan). |
HÓA TRỊ CỦA MỘT SỐ NGUYÊN TỐ VÀ NHÓM NGUYÊN TỬ:
| Hóa trị (I) | Hóa trị (II) | Hóa trị (III) | |
| Kim loại | Na, Ag, K | Ca, Cu, Ba, Zn, Fe, Mg, Pb, Hg | Al, Fe |
| Nhóm nguyên tử | -NO 3 ; (Ôi) (Tôi) | = CO3 ; = SO3 ; = SO4 | PO 4 |
| Phi kim | H, Cl, F | ồ |
Các phi kim khác: S (IV,VI ) ; C (IV) ; N (V) ; P (V).
Nắm trọn bộ kiến thức Toán, Lý, Hóa, Văn, Anh 9 học kì 1 với bộ sổ tay kiến thức HOCMAI
C. BÀI TẬP ÔN THI HỌC KÌ 1 MÔN HÓA 9
Bài 1: Viết những phương trình hóa học, thực hiện dãy chất chuyển hóa
a) Al → Al 2 O 3 → Al(NO 3 ) 3 → Al(OH) 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Na[Al(OH) 4 ] → Al 2 (SO 4 ) 3 → Kal (SO 4 ) 2 .12H 2 O
Hướng dẫn giải bài:
1) 4Al + 3O 2 2Al 2 O 3
2) Al 2 O 3 + 6HNO 3 → 2Al(NO 3 ) 3 + 3H 2 O
3) Al(NO 3 ) 3 + 3NH 3 + 3H 2 O → Al(OH) 3 + 3NH 4 NO 3
4) Al(OH)3 + NaOH → Na[Al(OH)4]
5) K[Al(OH) 4 ] + CO 2 → Al(OH) 3 + KHCO 3
6) 2Al(OH) 3 → 2Al 2 O 3 + 3H 2 O
7) Al 2 O 3 + 2NaOH + 3H 2 O → 2Na[Al(OH) 4 ]
8) 2K[Al(OH) 4 ] + 4H 2 SO 4 → Al 2 (SO 4 ) 3 + K 2 SO 4 + 4H 2 O
9) Al 2 (SO 4 ) 3 + K 2 SO 4 + 24H 2 O → 2KAl(SO 4 ) 2 .12H 2 O
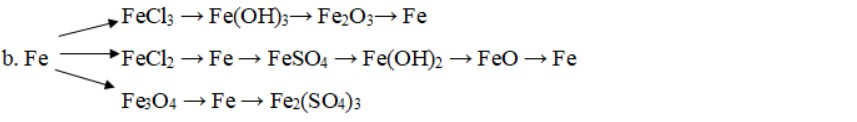
c. FeS 2 → SO 2 → SO 3 → H 2 SO 4 → CuSO 4 → Na 2 SO 4 → NaOH → Na 2 ZnO 2 .
Hướng dẫn giải bài:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 _ _ _
2SO 2 + O 2 → 2SO 3
SO3 + H2O → H2SO4 _ _ _
CuO + H2SO4 → CuSO4+ H2O
CuSO 4 + 2NaOH → Cu(OH) 2 ↓+ Na 2 SO 4
Na 2 SO 4 + Ba(OH) 2 → BaSO 4 ↓+ 2NaOH
Zn + 2NaOH → Na 2 ZnO 2 + H 2 ↑
d. Mg → MgSO 4 → Mg(OH) 2 → MgO → MgCl 2 → Mg(NO 3 ) 2 → MgCO 3 → MgO
Mg + H 2 SO 4 → MgSO 4 + H 2
MgSO 4 + NaOH → Mg(OH) 2 + Na 2 SO 4
Mg(OH) 2 → MgO + H 2 O
MgO + 2HCl → MgCl 2 + H 2 O
MgCl 2 + 2AgNO 3 → Mg(NO 3 ) 2 + 2AgCl
Mg(NO 3 ) 2 + CaCO 3 → MgCO 3 + Ca(NO 3 ) 2
MgCO 3 → MgO + CO 2
Bài 2: Nhận biết các chất (hợp chất) sau bằng những phương pháp hóa học
1. Các chất rắn
a) BaO, MgO, CuO
b) CuO, Al, MgO, Ag
c) CaO, Na2O, MgO và P2O5
d) Na 2 O, CaO, Ag 2 O, Al 2 O 3 , Fe 2 O 3 , MnO 2 , CuO.
e) P 2 O 5 , Na 2 CO 3 , NaCl, MgCO 3
f) NaOH, KNO 3 , CaCO 3 , MgO, P 2 O 5 , BaSO 4
a) BaO, MgO, CuO
Trích lần lượt các chất (hợp chất) ra để làm mẫu thử.
Cho hợp chất H2O vào lần lượt từng mẫu thử, mẫu nào tạo ra có thể kết tủa trắng là chất MgO, nếu tạo ra kết tủa xanh lơ thì là Cu(OH)2, nếu phản ứng bình thường thì là BaO.
BaO + H2O → Ba(OH)2
MgO + H 2 O → Mg(OH) 2
CuO + H2O → Cu(OH)2
b) CuO, Al, MgO, Ag
Trích dẫn lần lượt các chất ra để làm mẫu thử.
Cho chất H2O vào lần lượt những mẫu thử sau, mẫu thử nào mà xuất hiện kết tủa trắng thì là MgO , nếu xuất hiện kết tủa xanh lơ thì là CuO, nếu xuất hiện kết tủa keo trắng và có khí bay ra thì là Al, còn nếu không tác dụng được thì là Ag.
MgO + H 2 O → Mg(OH) 2
CuO + H2O → Cu(OH)2
Al + H 2 O → Al(OH) 3 + H 2
c) CaO, Na2O, MgO và P2O5
Trích mỗi chất (hợp chất) một ít để làm mẫu thử, lần lượt cho các chất (hợp chất) vào trong nước:
+ Chất không tan là chất MgO.
+ Chất tan là chất Na2O, CaO, và P2O5
Phương trình hóa học:
Na 2 O + H 2 O → 2NaOH
CaO + H2O → Ca(OH)2
P 2 O 5 + 3H2O → 2H 3 PO 4
Cho giấy quỳ tím vào dung dịch ta thu được:
+ Chất làm quỳ tím hóa đỏ là chất: H3PO4 → chất ban đầu là chất P2O5
+ Chất làm quỳ tím hóa xanh là chất: NaOH và Ca(OH)2.
Sục khí CO2 qua 2 dung dịch làm cho quỳ tím hóa xanh:
+ Dung dịch có xuất hiện kết tủa trắng là dd Ca(OH)2 → chất ban đầu là chất CaO:
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
+ Dung dịch không xuất hiện hiện tượng là dd NaOH → chất ban đầu là chất Na2O:
2NaOH + CO 2 → Na 2 CO 3 + H 2 O
d) Na2O, CaO, Ag2O, Al2O3, Fe2O3, MnO2, CuO.
Lấy mẫu thử của 8 chất bột vừa rồi, rồi dùng dung dịch HCl đặc để phân biệt:
Mẫu thử nào tan và có xuất hiện kết tủa màu trắng là chất Ag2O
Ag 2 O + 2HCl → 2AgCl + H 2 O
Mẫu thử nào tan và có xuất hiện khí màu vàng lục là chất MnO2.
MnO2 + 4HCl(đặc) → MnCl2+ Cl2+ 2H2O
Mẫu thử nào tan và có xuất hiện dung dịch có màu vàng nâu là chất Fe2O3.
Fe 2 O 3 + 6HCl → 2FeCl 3 + 3H 2 O
Mẫu thử nào tan và có xuất hiện dung dịch có màu xanh là chất CuO.
CuO + 2HCl → CuCl 2 + H 2 O
Mẫu thử nào tan và có xuất hiện dung dịch không màu là những chất Na2O, CaO, Al2O3.
Na2O + 2HCl → 2NaCl + H 2 O
CaO + 2HCl → CaCl 2 + H 2 O
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Dùng nước có pha dung dịch phenolphtalein vào ba mẫu thử chất bột của các chất Na2O, CaO, Al2O3.
Mẫu thử nào mà không tan là chất Al2O3.
Mẫu thử nào tan và làm cho dung dịch phenolphtalein hóa hồng là chất CaO, Na2O.
CaO + H2O → Ca(OH)2
Na 2 O + H 2 O → 2NaOH
Dùng dung dịch H2SO4 vào dung dịch vừa mới tạo thành của CaO, Na2O
Mẫu thử nào có xuất hiện kết tủa trắng thì ban đầu là chất CaO.
Ca(OH) 2 + H 2 SO 4 → CaSO 4 + 2H 2 O
Mẫu thử nào mà không xuất hiện hiện tượng thì ban đầu là chất Na2O.
2. Các dung dịch
a) HNO 3 , H 2 SO 4 , HCl, K 2 SO 4 , KNO 3 , KOH, Ba(OH) 2 .
b) HCl, NaOH, Na 2 SO 4 , NaCl.
c) HCl, H 2 SO 4 , NaCl, Na 2 CO 3
d) NaOH, BaCl 2 , Ba(OH) 2 , NaCl
e) Na 2 SO 4 , K 2 CO 3 , BaCl 2 , AgNO 3
f) KNO 3 , Cu(NO 3 ) 2 , AgNO 3 , Fe(NO 3 ) 3
3. Các chất khí
a) CO 2 , H 2 , N 2 , CO, O 2 , Cl 2
b) CO, CO2 , SO2 , SO3 , H2
c) CO, CO 2 , SO 2
4. Các kim loại
Al, Fe, Cu, Zn
Bài 3: Bài toán hỗn hợp
Hòa tan 8,9 gam hỗn hợp Zn và Mg một lượng vừa đủ vào dung dịch H2SO4 0,2M, ta thu được dung dịch A và 4,48 lít khí H2 ở đktc.
a. Tính thành phần tỷ lệ % theo khối lượng của mỗi kim loại?
b. Tính thể tích dung dịch axit đã được sử dụng?
Hướng dẫn giải bài:
n H2 = 4,48/22,4 = 0,2 mol
Gọi x, y lần lượt là hai số mol của Mg và Zn.
Phương trình phản ứng xảy ra:
Mg + H 2 SO 4 → MgSO 4 + H 2
x → x → x → x mol
Zn + H 2 SO 4 → ZnSO 4 + H 2
y → y → y → y nốt ruồi
n H2 = x + y = 0,2 (1)
Mặt khác ta có
24x + 65y = 8,9 (2)
Giải hệ phương trình (1) và (2) ta thu được:
⇒ x = 0,1; y= 0,1
nMg = 0,1 mol
m Mg = 0,1,24 = 2,4
%m Mg = 2,4.100/8,9 = 26,97%
%m Zn = 100 – 29,97= 73,03%
b) n H2SO4 = 0,2 mol
Vdd = 0,2/0,2 = 1 (lít)
Dựa vào những kiến thức và bài tập minh họa bên trên, các em hãy giải những bài tập sau đây:
Câu 1. Cho 27 gam hỗn hợp Al và ZnO vào trong dung dịch HCl 29,2% (một lượng vừa đủ) thì ta thu được 13,44 lít khí (đktc)
a) Tính % theo khối lượng mỗi chất (hợp chất) ở trong hỗn hợp ban đầu?
b) Tính khối lượng dung dịch HCl cần sử dụng?
c) Tính nồng độ % các muối có ở trong dung dịch thu được sau khi phản ứng?
Câu 2. Dẫn 10 lít hỗn hợp khí SO2 và CO thông qua dung dịch Ba(OH)2 dư. Sau phản ứng ta thu được 81,375 gam kết tủa. Tính thành phần % theo thể tích mỗi khí ở trong hỗn hợp ban đầu? (Biết rằng thể tích các khí đo ở đktc).
Câu 3. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột ZnO và CuO ta cần 73,5 gam dung dịch H2SO4 20%.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi chất oxit ở trong hỗn hợp ban đầu.
Câu 4. Cho 17,5 gam hỗn hợp gồm có 3 kim loại Zn, Al, Fe hòa tan hoàn toàn ở trong dung dịch H2SO4 0,5M, ta thu được 11,2 lít H2 (đktc). Tính thể tích dung dịch axit tối thiểu mà phải dùng và khối lượng muối khan sẽ thu được.
D. BỘ ĐỀ ÔN THI CUỐI HỌC KỲ I MÔN HÓA HỌC LỚP 9 (CÓ ĐÁP ÁN CHI TIẾT)
Sau đây là tổng hợp bộ tài liệu gồm 25 đề ôn thi học kỳ I môn Hóa 9 có lời giải chi tiết do HOCMAI tổng hợp. Các bạn học sinh hãy tham khảo, tải xuống rồi in ra giấy thực hành trực tiếp để đạt được hiệu quả luyện thi tốt nhất nhé!
Vậy là bài học Ôn thi hóa lớp 9 học kì 1 đến đây đã kết thúc rồi. HOCMAI mong rằng với lượng kiến thức ở bài viết trên đây, các em học sinh đã nằm lòng những kiến thức ấy, chuẩn bị cho mình một tâm lý vững vàng trước khi bước vào phòng thi. Những kiến thức trên sẽ đi cùng các em tới hết Trung học Phổ thông, vậy nên HOCMAI mong muốn các em hiểu chúng thật sâu sắc, ghi nhớ chúng thật lâu dài. Các em cũng đừng quên truy cập hoctot.hocmai.vn để tìm thêm cho mình thật nhiều bài học bổ ích nữa nhé!















